
Edu-talk
이매스교육 및 공지사항
Edu-talk
-
제목
[MALDI-TOF] MALDI-TOF MS의 전반적인 설명 - 이론 원리 및 실험 방법 -
작성자
이매스 -
첨부파일
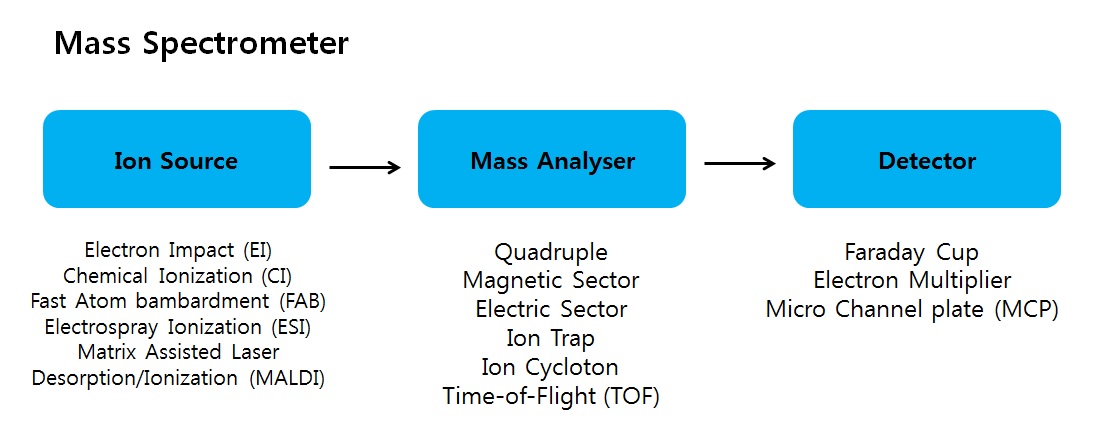
매스분석을 할때 이온화 하는 방법에는 여러가지가 있습니다
EI, CI, FAB은 분자구조를 깨서 이온화 시키는 방법으로 hard ionization이라고 하며,
분자구조를 유지시키며 H+ 를 붙이거나 떼는 방법으로 이온화 하는 Soft ionization (MALDI, ESI, APCI)방법도 있습니다
이 글에서는 Soft ionization중에서도 MALDI 이온화 방법에 대해서 알아봅니다.
1. MALDI-TOF MS (Matrix-assisted laser desorption ionization time of flight mass spectroscopy)
MALDI-MS는 1980년대에 개발되었으며 기존의 질량 분석법과는 다르게 극단적인 조건 (예, 열분해)이 필요하지 않고 column을 사용하지 않아 다루기가 상대적으로 쉽다. 최근에는 생물학, 특히 단백질체학이나 생물정보학 분야에서 각광을 받고 있으며 생체물질들의 특이성, 예를 들면 항원-항체 반응이나 DNA-DNA hybridization, 생체적합성 실험을 위한 단백질 흡착 등을 분석 하는 방법으로도 응용이 되고 있다. 단백질의 구조를 예로 들면, 기존의 X선 결정학과 더불어 NMR을 이용한 구조분석이 이미 중요한 기술로 사용되고 있는데, 이런 의미에서 MALDI는 생체 물질의 분석을 위한 방법으로 21세기의 생체물질 분석의 주요한 기술로 응용될 것이 분명하다.
1.1 MALDI-TOF MS의 장점
MALDI-MS는 분석체(analyte)의 조각으로부터 원래 분석체의 질량을 예측하는 기존의 질량 분광학과는 달리 분석체 자체의 이온을 검출하고 그 질량을 예측하는 것이다. 또 MALDI-MS는 PSD(post-source-decay) 방법을 사용하여 탈출관(flight tube)에서 자발적으로 펩티드 분해와 이온화를 진행시켜 미지의 펩티드나 단백질의 서열에 대한 직접적인 정보를 제공함으로써 펩티드나 단백질을 identification 할 수 있다. MALDI-MS는 검출할 수 있는 농도가 atto mole / nano gram으로 매우 낮으며 고분자의 경우, 그 분자량 분포도 단일 단량체의 해상도로 알아낼 수 있다.
a. High mass range
b. Speed of analysis
c. Sensitivity
d. Simplicity/ease-of-use
e. New research approach
f. Robustness/tolerance for sample impurities
g. Utility as a complement to other MS methods
h. Low cost
i. Basic interest in the technique
1.2 매트릭스 (Matrix)
MALDI-MS는 약한 이온화 기법으로 조사된 레이저 에너지가 결정화된 매트릭스를 통해 시료로 전달되어 이온화 되므로, 적당한 매트릭스의 선정 및 최적의 결정화가 실험 결과에 매우 중요한 영향을 미치게 된다.
아래는 주로 사용되는 Matrix와 그의 구조, 응용을 나타낸 것이다.
a. Sinapinic Acid - Protein > 10kDa 에 사용
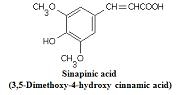

b. α-Cyano-4-hydroxy-cinnamic acid(CHCA) - Peptides < 10kDa 에 사용
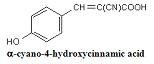
c. 2,5-Dihydroxybenzoic acid(2,5-DHB) - Neutral carbohydrates, Synthetic polymers 에 사용
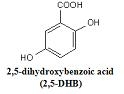
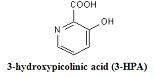
d. 3-Hydroxypicolinic acid(3-HPA) - Oligonucleotides 에 사용
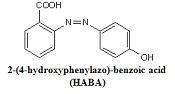
e. 2-(4-hydroxyphenylazo)-benzoic acid(HABA) - Protein, Oligosaccharides
MALDI-MS에서 sampling의 원리는 건조 방울법(dry droplet method)이라고 불리는 것으로 분석체를 UV를 잘 흡수하는 작은 물질(matrix)과 같이 섞어 용매에 녹이고 이것을 시료대에 올려 용매를 날린 후, UV 레이저로 조사하여 이온을 검출하는 것이다. 시료대에서 분석체 각 분자는 기질의 결정체에 잘 싸여 있어야 좋은 해상도를 낼 수 있고, 검출된 이온들은 [M+H]+의 방식으로 표현이 되며 고분자는 TOF 분석기를 이용하여 여러 중합체를 관측한다.
샘플의 탈착(desorption)과 이온화(ionization)의 mechanism은 아직 정확히 밝혀지지 않았지만 공통적으로 받아들여지는 부분은 1) matrix-analyte 간 반응은 전기적으로 여기 된 기질 분자와 중성의 분석체 분자간 여기상 수소전달(excited-state proton transfer)에 의해 시료대로부터 탈착된 입자 속에서 일어날 것이라는 것과 2) matrix-analyte 간 반응은 라디칼 분자 이온의 형성으로 기인 할 것이라는 점이다.
1.4 Instrumentation
a. 레이저 탈착 이온화 (Laser Desorption Ionization, LDI) ; 강력한 펄스 레이저로 고체 시료를 때려 이온화 시킨다.
b. MALDI ; 사용되는 레이저 파장을 잘 흡수하는 매트릭스 사용하며, 레이저의 흡수에 의해 시료-매트릭스의 온도가 급속히 상승, 붕괴, 방출된다.
d. 레이저 ; 펄스형 UV (UV/MALDI) or IR 레이저 (IR/MALDI)
UV - N2, Nd/YAG, Eximer
e. 펄스형 질량 분석관 ; Time of Flight(TOF)
linear TOF ; 가벼운 이온들은 무거운 이온들보다 먼저 검출기에 도착한다. 이 비행시간(time of flight)은 질량으로 다음 식에 의해 변환된다.
가속전압 ; V 운동에너지 1/2mv2 = eV
속도 v = (2eV/m)1/2 비행시간 t = 1/(2eV/m)1/2
Reflectron TOF ; 속도가 큰 이온 → Reflectron 내에서 더 먼 거리를 비행 → 검출기 위치에서 time focusing → 질량 분별능 커짐
2. 표면 MALDI-MS
기존의 MALDI와 표면 MALDI와의 차이점은 먼저 sampling에서 시작된다. 즉, 기존의 방법에서는 기질과 분석체를 섞어주었지만 표면 MALDI에서는 분석체가 시료대 위에 미리 흡착되어 있고 여기에 기질을 더해주게 된다. 표면 MALDI에서는 기질의 결정체가 일반적인 스테인레스 철 위에서 형성되는 것이 아니고 기판으로 사용되는 porous (or non-porous) 고분자 막에서 형성된다. 이런 고분자 막은 시료에 따라 다양한 재질이 사용됨으로써 MALDI의 신호 강도를 개선할 수 있다. 고분자 막은 기존의 생물학적 방법인 blotting 방법에서도 이용이 되지만 그것은 대개 높은 질량을 갖는 분자들의 해상도를 높이는 것이 목표이고, 표면 MALDI에서는 단백질과 생체재료 사이의 상호작용에 대한 정보를 얻는 것을 목표로 한다.
고분자 막 위에 미지의 생체시료를 미리 흡착시켜 시료를 준비하는 것을 제외하고는 기존의 MALDI와 비슷하다. 표면 MALDI의 생명은 기판에 흡착된 분석체를 기질 용액이 얼마나 잘 탈착시키는가에 있는데, 용매가 증발함에 따라 자라나는 기질 결정에 분석체 분자가 잘 파묻혀야 탈착이 잘 안 일어난다. 표면 MALDI의 검출 한계도 기존 MALDI와 같이 매우 낮은데, 예를 들어 콘텍트 렌즈 표면의 약 15% 정도를 덮고 있는 단일막의 lybozyme을 RFGD(amine radiofrequency glow discharge) 고분자 막에서 약 30 ng/cm2 까지 측정해 낼 수 있고 이론적으로는 1 ng/cm2 까지 검출할 수 있을 것으로 추측하고 있다.
3. Applications
a. 단백질 분석과 검출
단백질의 검출과 분석으로 많이 사용되는 방법은 전기영동(SDS-PAGE, sodium dodecyl sulfate-polyacrylamide gel electrophoresis)인데 낮은 분자량의 물질들은 많은 밴드들이 겹쳐져서 분해능이 좋지 않고, 특히 화학적 혹은 번역 후 변경(post-translational modification)에 의해 변화된 부분은 찾아내기 힘들다는 단점을 가지고 있다. 반면, MALDI-MS는 분해가 어려운 낮은 분자량의 물질들도 high sensitivity 와 high resolution로 구분할 수 있다. 즉, 밴드가 있는 gel을 잘라내어 녹이고, 존재하는 단백질의 분자량을 MALDI로 측정할 수가 있는데 SDS과 같은 물질이 잘 제거되지 않으면 측정해 내기 어려울 수도 있다. 밴드를 membrane에 전이시키고 이것을 잘라내어 MALDI로 분자량을 재는 방법도 있는데 SDS의 오염을 최소화할 수 있는 장점이 있다.
b. DNA Hybridization
기판 위에 공유 결합된 단일 가닥의 DNA는 신호가 보이지 않으나 그것의 상보적인 DNA가 결합하면 상보적 DNA의 신호는 나타나게 된다. 이것은 biochip으로의 이용이 가능하다.
c. 콜라겐을 이용한 표면 코팅
콜라겐은 세포가 결합할 수 있는 지지체 역할을 해주는 것으로 삼중체로 세 가닥이 꼬여 있다. 이런 CLM(collagen-like molecule)을 기질에 화학결합 시키면 삼중체의 피크가 다 나타나지는 않는데 이것은 곧 세 가닥 모두 공유 결합에 참여하지는 않기 때문이다.
d. 표면에 흡착된 지질의 분석
생체 재료는 몸 안에서 단백질 이외에 지질과도 접촉하기 때문에 생필름 표면에 지질의 흡착 여부를 파악해 볼 수 있다.
e. 생체 재료 표면에서 탄수화물의 역할 분석
glycosaminoglycan과 같이 단백질 결합에 중요한 탄수화물의 역할을 분석한다.
f. 미생물 분석
2,000 ~20,000 Da 정도 크기를 갖는 미생물의 특이적인 단백질을 분석하여 생체 재료 표면에 미생물의 부착 및 증식을 분석할 수 있다.
g. 생체 의료용 고분자 표면의 불순물 검출
고분자 표면에 남아있는 첨가제와 같은 불순물을 검출할 수 있다.
4. Caution
MALDI 기술은 아직도 더 개선이 필요한데 어떤 경우에는 XPS나 ELISA에 의해 검출되는 단백질이 표면 MALDI-MS에서는 보이지 않는 경우가 있다. 예를 들어, HSA(human serum albumin)의 MALDI-MS를 통한 검출은 재현성을 확보할 수가 없는데 이런 경우에는 대조 실험을 행함으로써 해결 될 수 있다. 즉, 표면 MALDI-MS로 검출되지 않는 단백질이 있다면 XPS나 ELISA를 통해서 관찰하는 것이다. 이렇게 재현성이 확보되지 않는 것은 다음과 같이 몇 가지 영향 요소가 작용한다.
a. 정체시간(effect of residence time)
단백질의 표면 흡착은 정체되는 시간에 따라 영향을 받는데 이것은 단백질이 재료 표면에서 변성 과정을 거치기 때문이다. 보통 변성을 통해 소수성 아미노산 부위가 노출이 되어 생체재료 표면의 소수성 부위와 결합하면 다시 떨어지기가 매우 힘들게 되는데 이외에도 vitronectin이나 fibronectin과 같이 자연적으로 매우 부착력이 강한 단백질은 단시간만 노출되어도 이와 같이 검출이 어렵다. 따라서 적절한 용매를 사용하는 것이 이런 문제를 해결하는 실마리를 제공할 수 있을 것이다.
b. 염(effect of salt)
약간의 염, 계면 활성제 혹은 분술물로의 당 등은 MALDI 신호에 큰 영향을 미칠 수 있다.
c. 잘못된 기질 사용
기질과 분석체가 서로 적합하지 않으면 각각의 결정이 따로 생기게 되어 분석이 되지 않을 수 있다. 일반적으로 기질이 많이 사용되므로 단백질은 초기에 주어진 방울의 가장자리 부근에서만 집중적으로 자라게 되어 분석이 어렵다. 또, Fig. 5. 와 같이 기질의 종류에 따라 형성되는 결정의 모양이 균일 하거나 그렇지 않는 경우가 발생하기도 한다.
1. Hans J. Griesser., Peter Kingshott., Sally L. McArthur., Keith M. McLean., Gary
R. Kinsel and R. B. Richard B. Timmons. Biomaterials. 2004, 25, 4861.
2. R. Zenobi and R. Knochenmuss, Mass Spectrom. Rev. 1998, 17, 337.
3. H. Goerisch, Anal. Biochem. 1998, 173, 393.
4. Bernd Thiede et. al. FEBS Letters. 1995, 357, 65.
